備考
診療報酬
D019(01),D019(02),D019(03)
補足情報
2025/09/12→大原
2019/08/01
未確認
2025/02/13
2025/02/13
2025/02/13
2025/02/13
2019/08/19
2025/02/13
2025/02/13
2025/09/12
2025/02/13
-
未確認
2019/08/01
一般細菌 結果判定基準 下記項目の検査結果は、次の当社基準に基づき、下記表示方法にて報告します。
項目名
区分および鏡検倍率
表示方法
細菌数/細胞数
備考
塗抹鏡検
細菌数※
(-)
菌がみられない
1+
1視野 <1
2+
1視野 1~5
3+
1視野 6~30
4+
1視野 >30
細胞数 (白血球・上皮細胞)
(-)
細胞がみられない
1+
1視野 <1
2+
1視野 1~9
3+
1視野 10~25
4+
1視野 >25
※カルチャーボトルおよび菌株でご依頼した際、細菌数の表示方法は「陽性」となります。
項目名
表示方法
培地発育状態
備考
培養同定
(-)
未発育
菌種名は、細菌命名に関する国際規約に基づき報告します。
1+
1/3未満
2+
1/3以上2/3未満
3+
2/3以上
4+
培地全面
項目名
区分および鏡検倍率
表示方法
細菌数
備考
塗抹鏡検
細菌数
(-)
菌がみられない
1+
1視野 <1
2+
1視野 1~5
3+
1視野 6~30
4+
1視野 >30
項目名
表示方法
培地発育状態
備考
培養同定
(-)
未発育
菌種名は、細菌命名に関する国際規約に基づき報告します。
1+
1/3未満
2+
1/3以上2/3未満
3+
2/3以上
4+
培地全面
項目名
区分および鏡検倍率
表示方法
細菌数/細胞数
備考
塗抹鏡検
細菌数
(-)
菌がみられない
1+
1視野 <1
2+
1視野 1~5
3+
1視野 6~30
4+
1視野 >30
細胞数 (白血球・上皮細胞)
(-)
細胞がみられない
1+
1視野 <1
2+
1視野 1~9
3+
1視野 10~25
4+
1視野 >25
項目名
表示方法
培地発育状態
備考
培養同定
(-)
未発育
菌種名は、細菌命名に関する国際規約に基づき報告します。
1+
1/3未満
2+
1/3以上2/3未満
3+
2/3以上
4+
培地全面
項目名
表示方法
内容
備考
薬剤感受性検査
S
Susceptible (感性)
CLSIの基準に基づき表示します。
I
Intermediate (中間)
R
Resistant (耐性)
CLSI:Clinical and Laboratory Standards Institute (旧NCCLS)
Result interpretation criteria for common bacteria Test results for items listed below will be reported in the following manner, according to the following SRL criteria:
TEST NAME
Category and
Result displayed
Bacterial count/cell count
Comment
Microscopic
Bacterial count※
(-)
No bacteria detected
1+
1 field < 1
2+
1 field 1-5
3+
1 field 6-30
4+
1 field > 30
Cell count (WBC/epithelial cells)
(-)
No cell detected
1+
1 field < 1
2+
1 field 1-9
3+
1 field 10-25
4+
1 field > 25
※ In the case of a culture bottle and a strain, the indication method of the number of bacteria becomes "positive".
TEST NAME
Result displayed
Growth in medium
Comment
Culture and
(-)
No growth
The species of bacteria are reported according to the International Code of Nomenclature of Bacteria.
1+
< 1/3
2+
≥ 1/3 to < 2/3
3+
≥ 2/3
4+
Entire surface of the medium
TEST NAME
Result displayed
Susceptibility
Comment
Drug
S
Susceptible
Results are reported according to the CLSI criteria.
I
Intermediate
R
Resistant
CLSI: Clinical and Laboratory Standards Institute (former NCCLS)
2025/09/12→大原
2018/07/04
2025/07/30
2023/07/07
2023/07/07
2023/07/07
2023/07/07
2019/08/07
2023/07/07
2023/07/07
2025/09/12
未確認
-
2020/11/17
2019/05/08
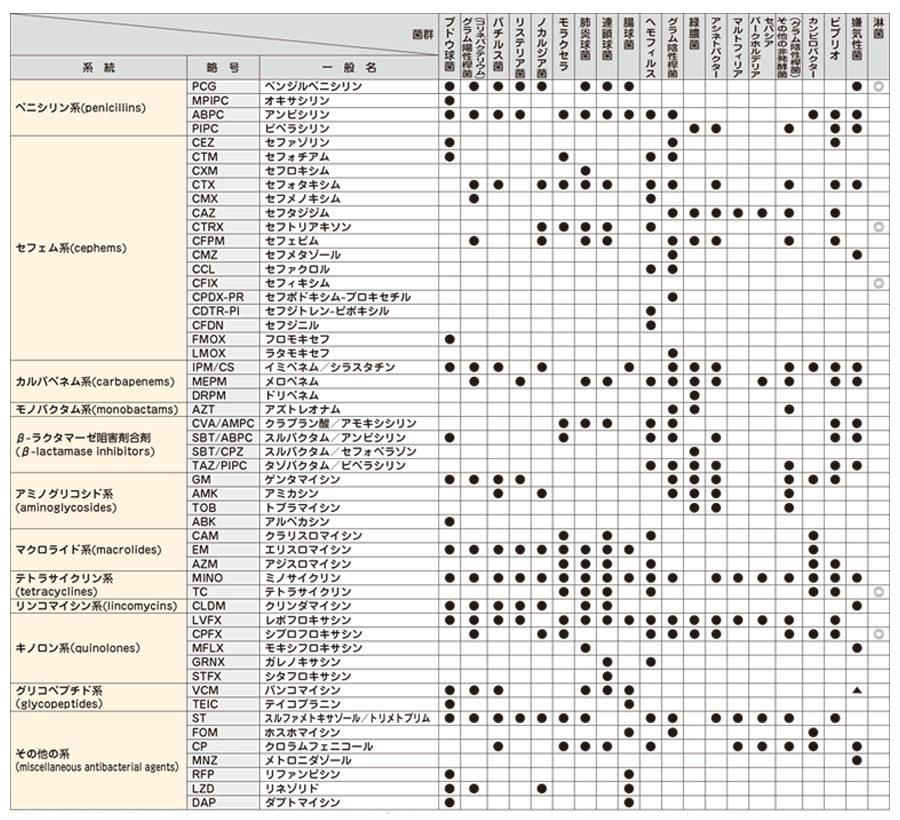
薬剤感受性標準セット
検出された菌種 (群) によって、効力の高い薬剤の組み合わせが検査されます。
上記一覧の菌種 (群) に該当しない場合は、当社にて薬剤の選定をさせていただきます。
検出された菌種によっては、標準薬剤パターンで検査できない場合もありますので、あらかじめご了承ください。
常在細菌 (Normal flora) の感受性検査は実施しておりません。
感受性検査の報告は下記カテゴリーにて報告します。
S:感性 (Susceptible)
I:中間 (Intermediate)
R:耐性 (Resistant)
▲:VCMは C.difficile 検出時報告します。
◎:淋菌はディスク拡散法を用いて検査します。
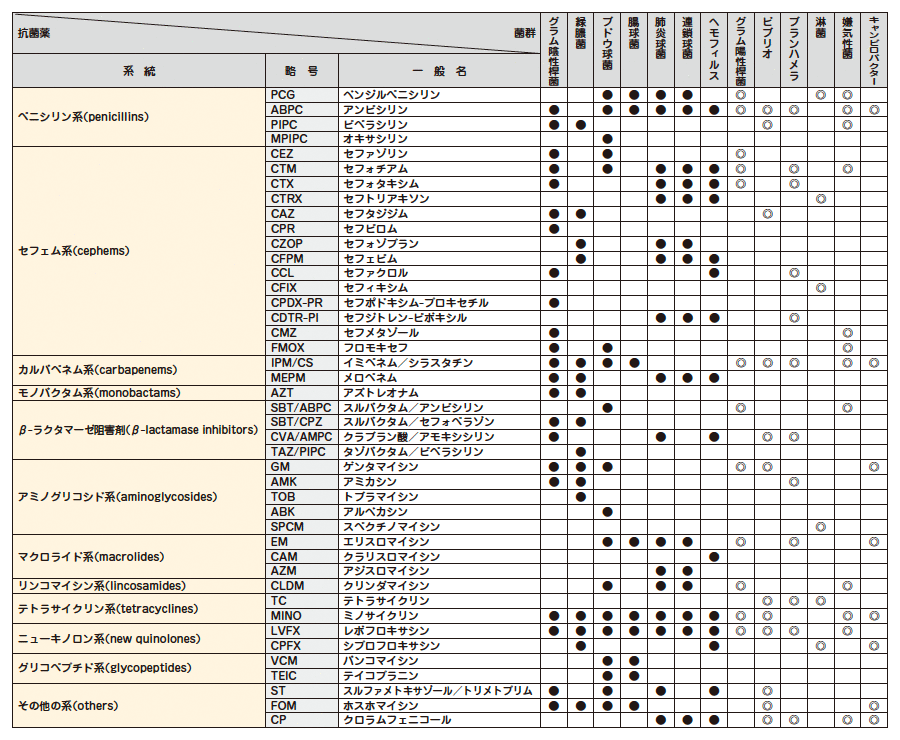
検出された菌種に対して、効力の高い薬剤の組み合わせが自動的に検査されます。
検出された菌種によっては、標準薬剤パターンで検査できない場合もありますので、あらかじめご了承ください。
Proteus mirabilis 、Serratia marcescens に対し、IPMの結果はご報告できません。Morganella morganii 、Serratia spp.に対し、CTXの結果はご報告できません。真菌および常在細菌(Normal flora)の感受性検査は実施しておりません。
感受性検査の報告は3段階でご報告いたします。
S:感性 (Susceptible)
I:中間 (Intermediate)
R:耐性 (Resistant)
●:微量液体希釈法で実施
◎:ディスク拡散法で実施
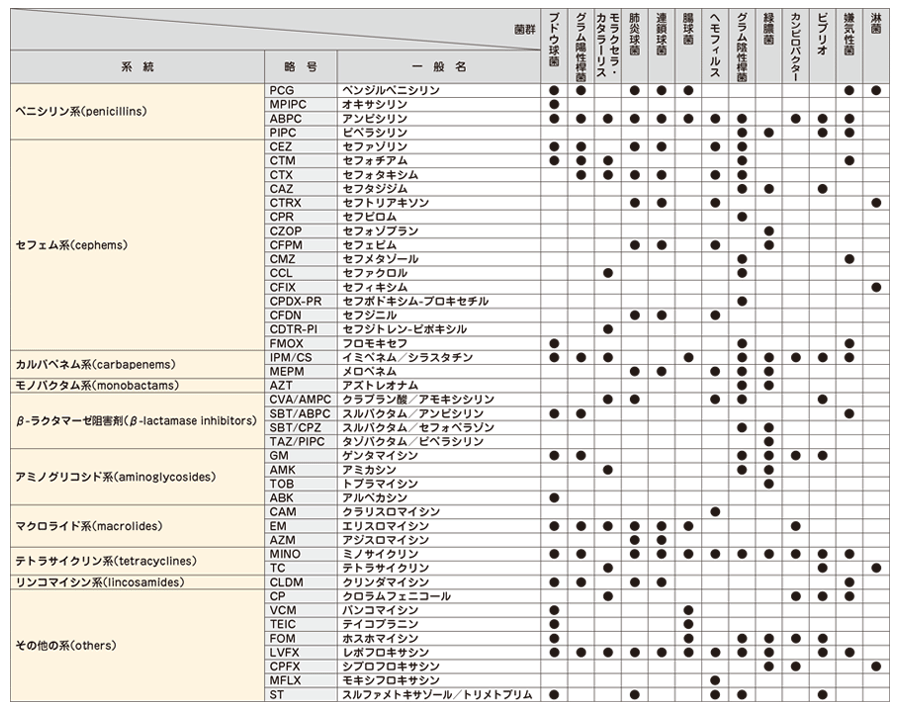
検出された菌種 (群) によって、効力の高い薬剤の組み合わせが検査されます。
上記一覧の菌種 (群) に該当しない場合は、当社にて薬剤の選定をさせていただきます。
検出された菌種によっては、標準薬剤パターンで検査できない場合もありますので、あらかじめご了承ください。
常在細菌 (Normal flora) の感受性検査は実施しておりません。
感受性検査の報告は下記カテゴリーにて報告します。
S:感性 (Susceptible)
I:中間 (Intermediate)
R:耐性 (Resistant)
一般細菌感受性薬剤名一覧
項目
略号
薬剤名
商品名
ペニシリン系
4501
PCG
ぺニシリン
バイシリン、結晶ペニシリン
4502
ABPC
アンピシリン
アミペニックス、ビクシリン
4503
CBPC
カルペニシリン
ダニべリン、ゼオペン
4504
SBPC
スルペニシリン
リラシリン
4506
AMPC
アモキシシリン
サワシリン、パセトシン
4509
PIPC
ピペラシリン
ペントシリン
4510
MPIPC
オキサシリン
スタフシリンV
4516
ACV
クラブラン酸・アモキシシリン
オーダメンチン
4518
ASPC
アスポキシシリン
ドイル
4519
SBTPC
スルタミシリン
ユナシン
4692
TAZ/PIPC
タゾバクタム/ピペラシリン
タゾシン
4694
SBT/ABPC
スパクタム/アンピシリン
ユナシン-S
セフェム系
4531
CET
セファロチン
ケフリン
4532
CER
セファロリジン
ケフロジン
4533
CEX
セファレキシン
ケフレックス
4534
CEZ
セファゾリン
セファメジン
4535
CFT
セファトリジン
セプチコール、ブリセフ
4537
CMZ
セフメタゾール
セフメタゾン
4541
CPZ
セフォペラゾン
セフォペラジン
4542
CTM
セフォチアム
パンスポリン、ハロスポア
4543
CFS
セフスロジン
タケスリン、チルマポア
4544
CZX
セフチゾキシム
エポセリン
4547
CTX
セフォタキシム
クラフォラン、セフォタックス
4548
LMOX
ラタモキセフ
シオマリン
4549
CCL
セファクロル
ケフラール
4550
CXM
セフロキシム
ジナセフ
4553
CMX
セフメノキシム
ベストコール
4557
CAZ
セフタジジム
モダシン
4558
CTRX
セフトリアキソン
ロセフィン
4559
CBT・CPZ
スルバクタム・セフォペラゾン
スルペラゾン
4560
CPIZ
セフピミゾール
アジセフ、レニラン
4561
CMNX
セフミノクス
メイセリン
4562
CFIX
セフィキシム
セフスパン
4563
CFTM
セフテラムピボキシル
トミロン
4564
FMOX
フロモキセフ
フリマリン
4566
CPDX
セフポドキシムプロキセチル
バナン
4567
CFDN
セフジニル
セフゾン
4568
CPR
セフピロム
ケイテン、ブロアクト
4570
CDTR
セフジトレンピボキシル
メイアクト
4571
CZOP
セフォゾプラン
ファーストシン
4572
CFPM
セフェピム
マキシピーム
4573
CFPN
セフカペン
フロモックス
カルバペネム系
4668
IPM
イミペネム
チエナム
4676
PAPM
パニペネム
カルベニン
4678
MEPM
メロペニム
メロペン
4685
DRPM
ドリペネム
フィニバックス
ペネム系
4681
FRPM
ファロペネム
ファロム
マクロライド系
4590
AZM
アジスロマイシン
ジスロマック
4591
EM
エリスロマイシン
エリスロマイシン、アイロタイシン
4599
CAM
クラリスロマイシン
クラリス
テトラサイクリン系
4601
TC
テトラサイクリン
アクロマイシン、ブリサイ
4602
DOXY
ドキシサイクリン
ビブラマイシン、ヒドラマイシン
4603
MINO
ミノサイクリン
ミノマイシン
クロラムフェニコール系
4611
CP
クロラムフェニコール
クロロマイセチン
アミノグリコシド系
4621
KM
カナマイシン
カナマイシン
4623
GM
ゲンタマイシン
ゲンタマイシン
4625
DKB
ジベカシン
パニマイシン
4626
AMK
アミカシン
ビクリン、アミカマイシン
4627
TOB
トブラマイシン
トブラシン
4628
SM
ストレプトマイシン
硫酸ストレプトマイシン
4634
ISP
イセパマイシン
エクサシン、イセパシン
4635
ABK
アルベカシン
ハベカシン
モノバクタム系
4666
AZT
アズトレオナム
アザクタム
リンコマイシン系
4651
LCM
リンコマイシン
リンコシン
4652
CLDM
クリンダマイシン
ダラシン
キノロン系
4656
NA
ナリジクス酸
ウイントマイロン、ナイスレート
4660
NFLX
ノルフロキサシン
バクシダール
4662
OFLX
オフロキサシン
タリビッド
4669
CPFX
シプロフロキサシン
シプロキサン
4671
LFLX
ロメフロキサシン
バレオン、ロメバクト
4672
TFLX
トスフロキサシン
オゼックス、トスキサシン
4674
SPFX
スパルフロキサシン
スパラ
4677
LVFX
レボフロキサシン
クラビット
4683
GFLX
ガチフロキサシン
ガチフロ
4693
PUFX
プルリフロキサシン
キスノン、スォード
4684
PZFX
パズフロキサシン
パシル、パズクロス
その他
4653
PL
ポリミキシンB
硫酸ポリミキシンB
4654
CL
コリスチン
コリマイシン、メタコリマイシン
4658
ST
スルファメトキサゾール・トリメトプリム
バクタ、バクトラミン
4665
FOM
ホスホマイシン
ホスミシン、ホスミシンS
4673
VCM
バンコマイシ
塩酸バンコマイシン
4680
REP
リファンピシン
リファジン
4682
TEIC
テイコプラニン
タゴシット
Standard sets for drug susceptibility testing
According to the bacterial species (groups) detected, a combination of agents that is effective will be used for testing.
For those other than the bacterial species (groups) listed above, SRL will select agent(s) for use.
Please note that the standard patterns of agents may not be used depending on the bacterial species (groups) detected.
Susceptibility testing is not performed for the normal flora.
Results of the susceptibility test will be reported using the following categories:
S:Susceptible
I :Intermediate
R:Resistant
▲:VCM will be reported if C. difficile is detected.
◎:Testing for N. gonorrhoeae will be performed using disk diffusion method.
2025/09/12→大原
2019/08/30
2025/03/18
2025/03/18
2025/03/18
2025/03/18
2025/03/18
2025/03/18
2025/03/18
2025/03/18
2025/09/12
2025/03/18
-
2025/03/18
2025/05/15
List of dedicated transport containers and transport media
Classification
Material
Specimen volume (mL)
Storage condition
Collection container
Cavity, Airway or Respiratory system
Sputum
2-3
X00
Sterile sputum collection containers
Throat swab fluid
Appropriate amount
VS1
eSwab105 Regular FLOQ Swab
Gastrointestinal tract
Fecal
Appropriate amount
F01
Cary Blair feces collection tube
Bile
5-10
ARR
Sterile plastic tube for 10mL
Gastric fluid
2-3
ARR
Sterile plastic tube for 10mL
Urinary and Reproductive Organs
Midstream urine
5-10
ARR
Sterile plastic tube for 10mL
Catheter urine
5-10
ARR
Sterile plastic tube for 10mL
Vaginal secretions
Appropriate amount
VS1
eSwab105 Regular FLOQ Swab
Pus
Appropriate amount
VS1
eSwab105 Regular FLOQ Swab
Blood and paracentesis fluid
Venous blood
Optimal amount
CBG
Blood Culture Bottle
Arterial blood
CBG
Blood Culture Bottle
Cerebrospinal fluid
2-3
C10
Seed Tube II
Pleural fluid
5-10
C10
Seed Tube II
Ascites
5-10
C10
Seed Tube II
Synovial fluid
5-10
C10
Seed Tube II
Other sites
Otorrhea
Appropriate amount
VS2
eSwab106 Mini Tip FLOQ Swabs
Eye discharge
Appropriate amount
VS1
eSwab105 Regular FLOQ Swab
Skin
Appropriate amount
ARR
Sterile plastic tube for 10mL
Nails
Appropriate amount
ARR
Sterile plastic tube for 10mL
Tissue
Appropriate amount
ARR
Sterile plastic tube for 10mL
Pus
Appropriate amount
C10
Seed Tube II
Others
Environmental materials
-
C30
Stamp culture media (for hospital environment test)
-
VS1
eSwab105 Regular FLOQ Swab
Gastric biopsy tissue
Appropriate amount
C20
Seed tube HP (for Helicobacter culture identification)
Fecal
1.0g
F00
fecal container
ARR Previous container symbol
r Sterile polyethylene test tube
Storage conditions: Room temperature
C10 Previous container symbol
n
C20 Previous container symbol
n2
C30 Previous container symbol
n3
CBG Previous container symbol
m1
CBS Previous container symbol
q1
F00 Previous container symbol
U Stool container
Storage conditions: Room temperature
F01 Previous container symbol
d3
VS1 Previous container symbol
k
VS2 Previous container symbol
k1
X00 Previous container symbol
l (Small letter L) Sterile sputum collection container
Storage conditions: Room temperature
Bacteria test collection method
Be sure to indicate the name of the material to be tested or the site from which the material was collected.
If the target organisms are Neisseria gonorrhoeae or Neisseria meningitides, store at
Test material for anaerobic culture should be collected in Seed Tube II.
Note that the number of days required will vary depending on the target bacteria and other factors.
Handling Instructions for Seed Tube II
■ Fluid specimens (paracentesis fluid, digestive fluids, etc.)
Sterilize the puncture site (the small circle on the rubber cap)
with rubbing alcohol or other sterile cotton.
Puncture the syringe needle vertically into the puncture site
and inject the fluid specimen.
Attach the tube label and transport.
Specimens should be tested immediately.
If preservation is unavoidable, store at
■ Solid specimens (pus, feces, tissue fragments, etc.)
Sterilize the rubber cap with sterile alcohol cotton, etc.
Remove the rubber cap and insert a solid specimen.
Insert the specimen all the way into the agar.
(Note) Cotton swabs up to 7 cm in length can be inserted.
Quickly and securely close the rubber cap.
Attach the tube label and transport.
Specimens should be tested immediately. If preservation is unavoidable, store
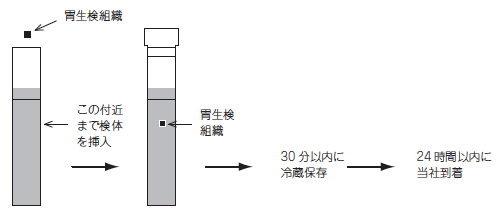
Helicobacter culture identification collection method Handling Instructions for Seed Tube HP
Place the collected “gastric biopsy tissue” immediately into
the collection container (C20) and insert it below the black line.
Specimens should be stored within 30 minutes and requested on the same day.
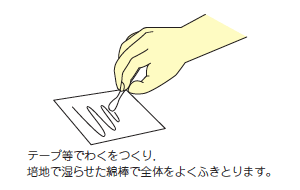
Environmental Inspection Collection Methods
Hospital environment (wipe method)
Wipe a specific area of the specimen (usually 10cm x 10cm)
well with the cotton swab (moistened with medium beforehand) provided
with the eSwab105 Regular FLOQ Swab,
and re-insert the swab into the medium before submitting it.
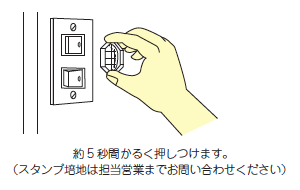
Hospital environment (stamp method)
Remove the cap of the stamping medium (C30),
and gently press the surface of the medium onto the specimen,
being careful not to touch the surface with your fingers.
After about 5 seconds, put the cap back on and submit the specimen.
参考文献
測定法文献

![]()