現在のラボ:セントラルラボ

項目コード:00W58 5(旧 0W58 4)
検査項目
JLAC10
リアルタイムPCR
PCR法を基本原理とする核酸増幅法の一種であり、分解により蛍光を発するオリゴヌクレオチドを利用することにより、PCRサイクルごとに蛍光シグナルを確認することでリアルタイムにターゲット核酸の定量が可能となる測定方法。
![]()
指定容器(V41)以外でのご依頼はできません。
検体に血液が混入していると、データに影響を及ぼす場合がありますのでご注意ください。
本検査方法ではコンタミネーションの影響がより大きくなりますので、検体採取にあたっては取り扱いに充分ご注意ください。
●留意事項
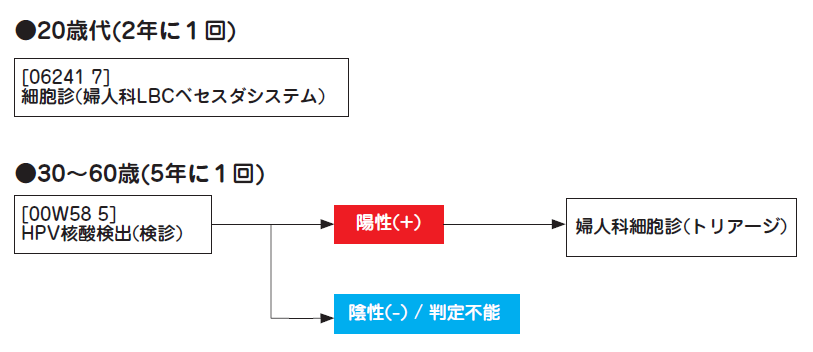
・HPV検査単独法による子宮頸がん検診用の検査項目です。
・本検査の判定結果が「陽性(+)」の場合、「婦人科細胞診(トリアージ)」を追加いたします。
・「婦人科細胞診(トリアージ)」の所要日数は4~7日です。
・ロシュ・ダイアグノスティックス社の「コバス®6800/8800システムHPV」を用いています。
測定対象は16型、18型、その他ハイリスクグループ(31、33、35、39、45、51、52、56、58、59、68型および66型)です。
・検体の返却はいたしません。
内容:メタノール55%
貯蔵方法:室温
有効期間:製造から1年6ヵ月
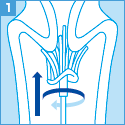
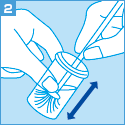

[ご注意]
妊婦より細胞を採取する場合、使用できる採取器具等に制限があります。
サーベックスブラシは妊娠10週以降禁忌、
サイトピックの子宮頸管内検体採取用端子は妊娠週数にかかわらず禁忌となりますのでご留意ください。
なお、綿棒は使用しないでください。
※ HPV核酸検出 (検診) のみをご希望の場合、担当営業員へご相談ください。
HPV陽性検体のみの検体返却が可能です。
2024年2月、厚生労働省による「がん予防重点健康教育及びがん検診実施のための指針」が改正となり、同月に「対策型検診におけるHPV検査単独法による子宮頸がん検診マニュアル」が公表されました。2024年4月以降、要件を満たした自治体において、HPV検査単独法の導入が可能となりました。
HPV検査単独法とは、30~60歳を対象にHPV検査を実施し、陽性とされた場合にのみ追加的にトリアージ検査として同一検体を用いた子宮頸部の細胞診を実施する方法です。現行の細胞診の検診間隔は2年ごとですが、HPV検査単独法では5年ごととなることから、受診者の負担軽減による受診率向上が期待されています。
本検査は、HPV検査単独法のアルゴリズムに従い、HPV検査およびトリアージ検査を実施いたします。自治体の子宮頸がん検診において、HPV検査単独法を採用する場合、本検査をご依頼ください。
子宮頸癌
測定法文献
三浦 俊昭,他:医学と薬学 69(1):157~162, 2013.
臨床意義文献
対策型検診におけるHPV検査単独法による子宮頸がん検診マニュアル:2024.